La chirurgia del glaucoma ad angolo aperto si è avvalsa fino alla fine degli anni 90 quasi esclusivamente di tecniche fistolizzanti, capaci cioè di creare una derivazione, una via di deflusso alternativa creata ad arte (la fistola) che in modo libero (trabeculectomia, sclerectomia profonda) o con l’ausilio di tubi di varia foggia dimensione e materiale (long tubes/valvole) consentisse uno scarico dell’umore acqueo all’esterno del bulbo sotto la protezione del complesso congiuntiva-tenone. Interventi questi dotati tutti di una grande efficacia ipotensiva, ma sempre forieri di complicanze intra e postoperatorie serie, a volte gravi (ipoema, effusione coroideale, pieghe maculari da ipotono). La ricerca biotecnologica si è sempre adoperata per introdurre tecniche e dispositivi che a fronte di un risultato meno eclatante, offrissero una notevole riduzione di queste complicanze.
Il progenitore di questi device fu sicuramente l’EX-PRESS, un dispositivo filtrante che prima con diametro interno di 50 µ poi con 200 µ veniva collocato sotto un flap sclerale analogo a quello di una trab eliminando i tempi della sclero-iridectomia.
Ancora oggi viene adoperato con successo grazie ad un ottimo rapporto efficacia/sicurezza; grava su di esso un problema di costi non giustificati dalla sua invasività che definiremmo “media” e dal fatto che gli attuali protagonisti sul mercato sembrano offrire con gli stessi costi, altri plus, come vedremo a breve. La storia di EX-PRESS comunque insegna che tutti i dispositivi nascono dalla ricerca condotta da piccole aziende e studiosi appassionati, ma la sperimentazione clinica su vasta scala e la relativa diffusione del prodotto a livello mondiale non si sviluppano fin quando non si fa avanti una multinazionale che impegni grandi risorse per finanziare trial clinici, portare risultati convincenti e reclutare così un gran numero di users. D’altro canto le procedure ideate e proposte sono tante in virtù della complessità architettonica dell’angolo camerulare, dove ogni microstruttura può essere bypassata, conformata, perforata o ablata.
MIGS: Mini Invasive Glaucoma Surgery
È d’obbligo individuare i caratteri distintivi della vera M.I.G.S.:
• approccio ab interno, contestuale o meno alla faco;
• chirurgia in visione angolare con testa microscopio-testa del paziente ruotati antiteticamente per un angolo di 60°;
• efficacia ipotensiva max del 25% rispetto al baseline;
• % di complicanze molto bassa;
• indipendenza dalle condizioni della congiuntiva;
• non uso degli antimitotici.
Illustriamo dunque le varie tecniche una per una.
By Pass Trabecolare
La azienda americana GLAUKOS propose nel 2012 un minidispositivo in acciaio che perforava il trabecolato iuxtacamerulare mettendo in co- municazione la camera anteriore direttamente con lo Schlemm; questo dispositivo nel 2018 venne reso disponibile col nome di iStent Inject (Fig. 1) e venne modificato sia nella forma sia nella tecnica di impianto, in quanto collocato in coppia su un inserter che consente di “spararli” uno dopo l’altro nel trabecolato del SNI a circa 2 quadranti orari di distanza.
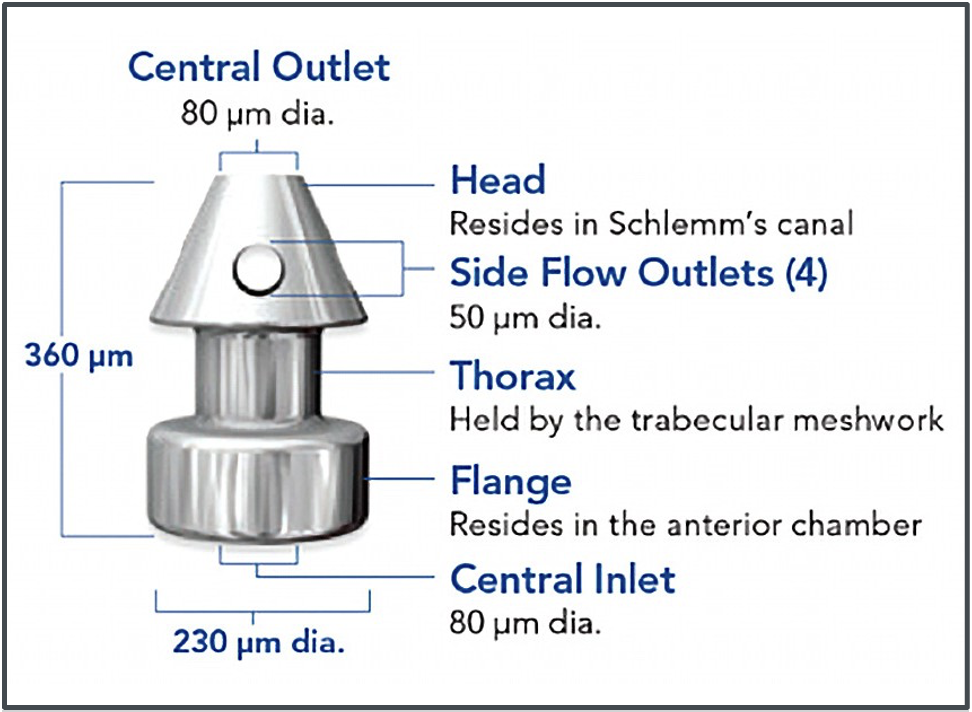
Fig. 1
Sebbene l’iStent sia destinato a essere impiantato in corso di chirurgia della cataratta, studi prospettici internazionali hanno valutato l’iStent come una procedura autonoma. In questi studi, la riduzione media della PIO varia da 10,2 a 12,2 mmHg (39,7%–48,4%) in 1–3 anni di follow-up. Il 72,0%–94,7% ha ottenuto una riduzione della PIO ≥20%.
Uno studio ha confrontato l’iniezione di iStent come procedura autonoma con un gruppo di terapia medica, costituito da una combinazione fissa di latanoprost/timolololo.
Entrambi i gruppi avevano una diagnosi di OAG da lieve a moderato. Circa il 95% dei pazienti iStent ha raggiunto una riduzione della PIO ≥ 20% senza la necessità di farmaci per il glaucoma nell’arco di 12 mesi. Al contrario, il 91,8% dei pazienti nel gruppo di terapia medica ha raggiunto questa riduzione della PIO nello stesso periodo di tempo.
Le complicanze si sono rivelate sempre rare, lievi e transitorie (modesta emorragia intraoperatoria, momentanea dislocazione dello stent durante l’impianto).
By Pass Trabecolare + Remodeling Schlemm
Un altro microstent per impianto diretto nel canale di Schlemm è Hydrus, sviluppato da Ivantis, Inc. (Irvine, CA, USA ). L’Hydrus adotta una strategia diversa per ampliare l’area di copertura; invece di utilizzare più stent, è di per sé un dispositivo più lungo che, con i suoi di 8 mm, copre tre quadranti orari del canale di Schlemm, fornendo una dilatazione localizzata dello Schlemm ed un bypass diretto della rete trabecolare grazie alle fenestrature che rendono più accessibili all’acqueo gli ostii dei suoi canali collettori (Fig. 2). Diversi studi prospettici hanno confrontato FACO-HYDRUS con la sola FACO. Questi studi mostrano che FACO-HYDRUS può abbassare significativamente la IOP di 7,6–8,1 mmHg rispetto al basale nell’arco di 2–3 anni. Inoltre, a 2–3 anni, il 64,0%-78,5% degli occhi sottoposti a faco/Hydrus ha avuto una riduzione della PIO≥20% rispetto solo al 46,0%-57,8% degli occhi sottoposti a sola chirurgia della cataratta. Circa il 55,8%–78,5% degli occhi FACO/HYDRUS erano anche senza farmaci a 2–3 anni rispetto al 30,0%–39,2% di quelli sottoposti a sola chirurgia della cataratta. Le complicanze anche per questa tecnica si sono rivelate sempre rare, lievi e transitorie (modesta emorragia intraoperatoria durante l’impianto).
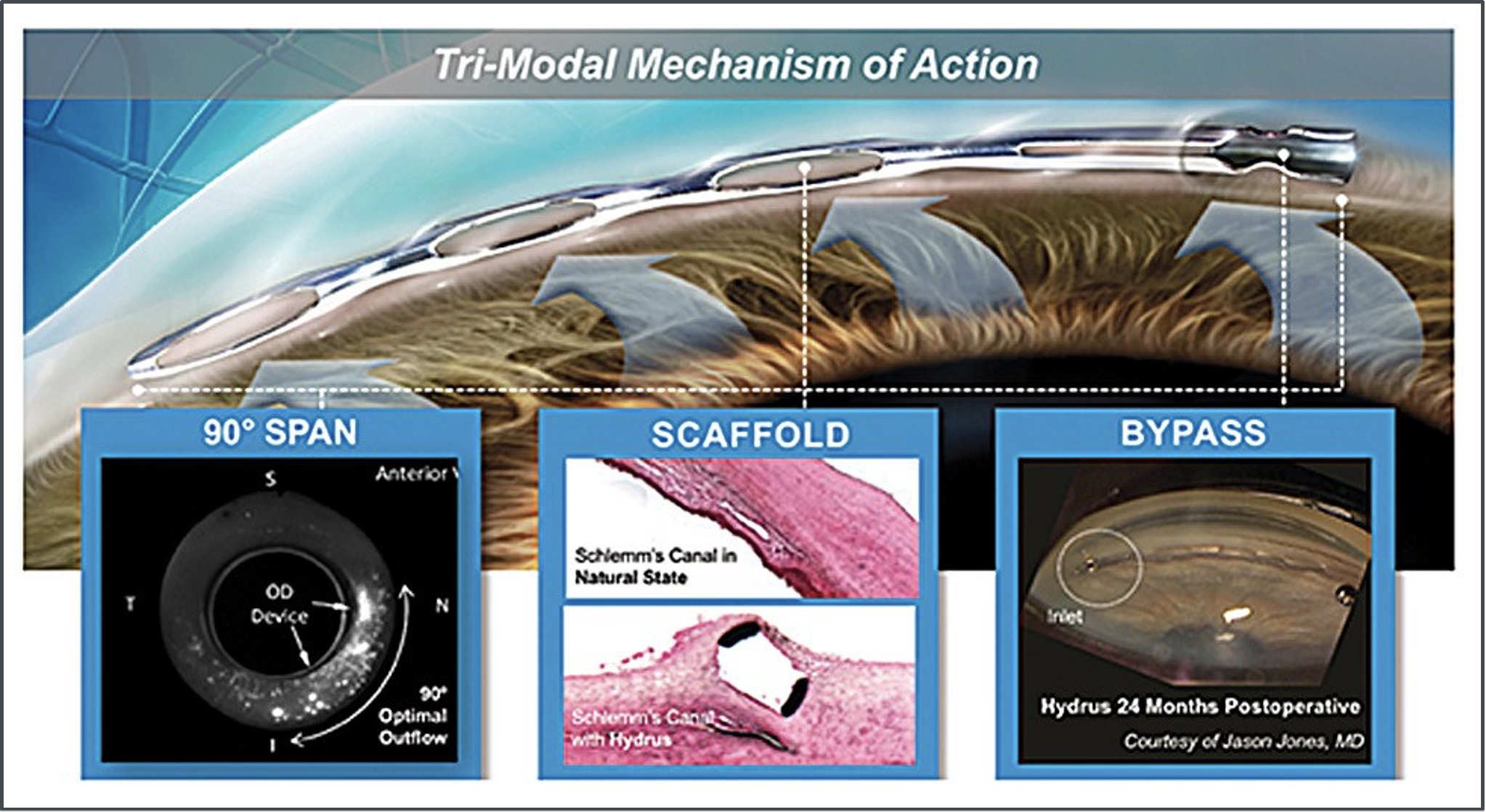
Fig. 2
ELT: Trabeculotomia con Laser a Eccimeri
La azienda tedesca TuiLaser AG ha progettato più di 10 anni fa una sonda a eccimeri endoculare che con lunghezza d’onda di 308 nm, emissioni di spot di potenza e diametro prestabiliti, può eseguire circa 8-12 perforazioni del trabecolato su max 120° di circonferenza.
In un lavoro di autori italiani, la trabeculotomia ab interno è stata eseguita utilizzando il laser ad eccimeri XeCl recentemente sviluppato in 21 occhi di 21 pazienti con glaucoma primario ad angolo aperto refrattario alla terapia medica. I pazienti sono stati seguiti, per una media di 25,3 +/- 1,3 mesi. Diciannove pazienti (90,5%) hanno avuto una riduzione della PIO pari o superiore al 20%; tuttavia, 8 di questi occhi (38,1%) hanno richiesto una terapia medica aggiuntiva per ridurre la PIO. La procedura è fallita in 2 casi (9,5%) nonostante la terapia aggiuntiva. Rari episodi di ipoema transitorio e nessuna complicanza endoteliale vengono riportati dagli Autori.
Ablazione trabecolare
Le tecniche di goniotomia e trabeculotomia, da tempo pilastro nella gestione chirurgica dei glaucomi pediatrici e congeniti, negli ultimi anni sono state utilizzate nel glaucoma dell’adulto.
Il Kahook Dual Blade KDB (New World Medical) e il più recente Goniotome (NeoMedix Corp. Fig. 3) sono strumenti capaci di eseguire una asportazione del tessuto trabecolare per un arco di circa 100-120°.
L’efficacia della KDB standalone è stata ampiamente dimostrata attraverso revisioni retrospettive con riduzioni della IOP comprese tra 4 e 11 mmHg (14,5% e il 36,0%) con follow-up di 6-12 mesi.
La KDB ha dimostrato di essere altrettanto efficace in combo con la chirurgia della cataratta. Utilizzando il punteggio di riduzione della IOP del 20% come end point, la FACO/KDB ha dimostrato che il 72% degli occhi aveva una riduzione della IOP ≥20%, sovrapponibile al solo KDB.
In termini di riduzione dei farmaci, la KDB e la faco/KDB possono ridurre i farmaci di 0,1–2,1. Possiamo considerare una seconda opzione. Rispetto ad una goniotomia limitata che utilizza una doppia lama specializzata, in cui il tessuto viene asportato a 180 gradi rispetto al chirurgo, la procedura di trabeculotomia transluminale assistita da gonioscopia (GATT) CHE utilizza un microcatetere per creare un’infrattura ab-interno circonferenziale del trabecolato. Il device viene introdotto nello schlemm attraverso una piccola incisione, spinto con pinza vitreale per i 360° fino a fuoriuscire dalla stessa incisione dal lato opposto e infine tirato come una cravatta dalle due estremità.
I punti di forza di questa tecnica includono la capacità di raggiungere tutti i 360 gradi del sistema di deflusso. I dati retrospettivi sugli esiti a lungo termine hanno documentato un’efficacia continua per la stragrande maggioranza dei pazienti ed una applicabilità su diverse tipologie di glaucoma.
I risultati di uno studio del 2022 in cui sono stati inclusi un totale di 73 occhi (GATT=38; PHACO- GATT=35) di 58 pazienti con un’età media di 54,8±11,6 anni riporta che, dopo 12 mesi di fol- low-up, la IOP media è stata ridotta da 24,9±8,5 a 12,1±2,1 mm Hg (P<0,001). Il numero medio di farmaci per il glaucoma è stato ridotto da 3,5±0,7 a 1,2±1,2 (P<0,001).
Il tasso di successo quindi è stato dell’87% a 12 mesi, senza differenze significative tra gli occhi GATT (85%) e PHACO-GATT (91%).
Le complicanze rivelate in percentuali minime erano quasi sempre emorragie intraoperatorie e rari episodi di ipotono risolti spontaneamente.
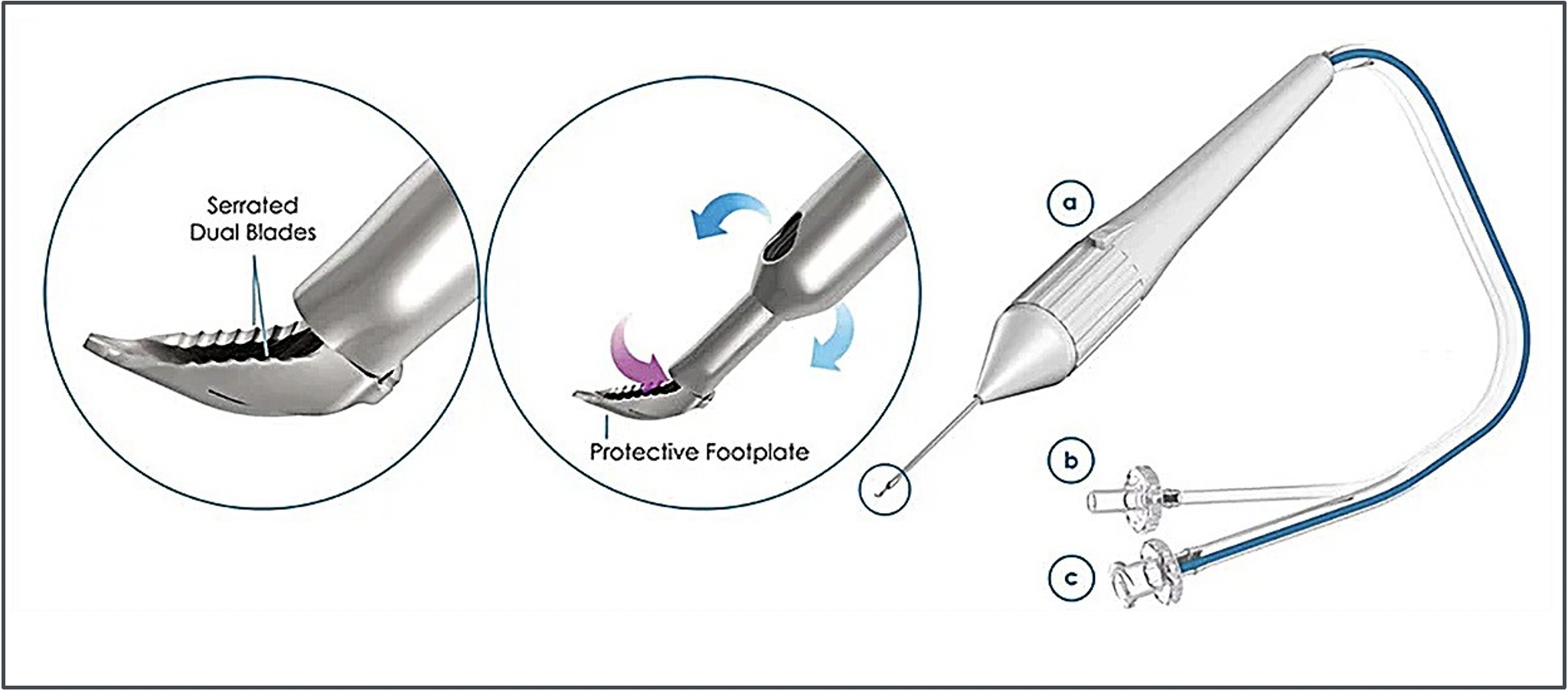
Fig. 3
Riabilitazione canalicolare
Nel tentativo di essere ancora meno dannosi per le strutture anatomiche esistenti dell’angolo della camera anteriore, è stata utilizzata la viscodilatazione per ridurre la resistenza al deflusso nel tessuto della rete trabecolare distendendo e allargando il canale di Schlemm, l’adiacente rete trabecolare iuxtacanalicolare e i canali collettori distali, ottenendo così con tecnica non ablativa una riduzione della PIO.
Parliamo di canaloplastica ab-interno, o Ab.I.C: un microcatetere illuminato viene inserito per 360° nel canale di schlemm e, durante il suo cammino a ritroso verso il punto di entrata, rilascia lentamente piccole dosi di un viscomateriale coesivo che hanno lo scopo di dilatare il canale stesso (Fig. 4).
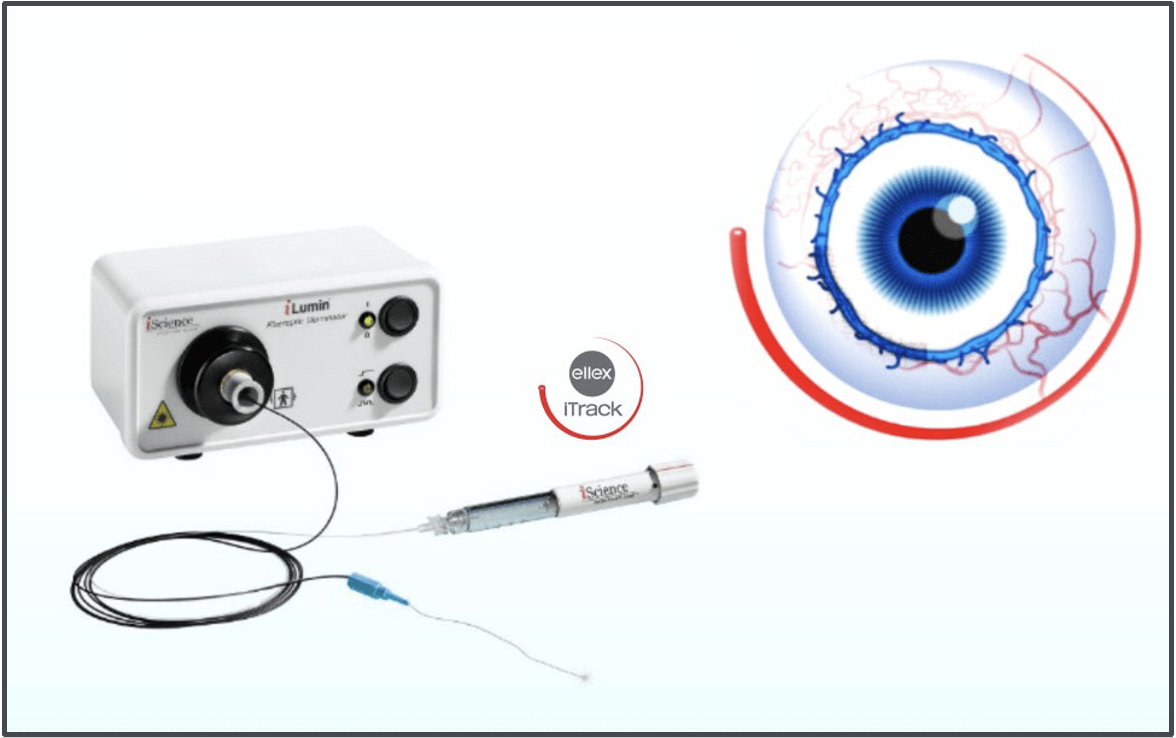
Fig. 4
Uno studio a 12 mesi riporta che la PIO è diminuita da 19,8 ± 4,1 a 13,8 ± 3 mmHg in tutti gli endpoint (1 giorno p < 0,001; 6 settimane p < 0,001; 3 mesi p < 0,001; 6 mesi p = 0,001; 12 mesi p < 0,001). La terapia per il glaucoma si è stabilizzata al numero di 2,1 ± 1,6 farmaci dopo 12 mesi dall’intervento.
Non si segnalano complicanze intra o postoperatorie maggiori.
Tecniche angolari: criticità
In primo luogo, viene riconosciuto il fatto che in varia percentuale da studio a studio può verificarsi la formazione di cicatrici nell’area dell’impianto del microstent o della microincisione. Inoltre, i pazienti con glaucoma possono avere una resistenza clinicamente significativa al deflusso distale al canale di Schlemm condizionando l’efficacia di riduzione della PIO dopo l’intervento, che non può naturalmente andare al di sotto di quella delle vene episclerali.
Non ci si può pertanto aspettare da tutte queste tecniche angolari un dropout tonometrico superiore ad un 25-30% dei valori di baseline, e per ottenere di più diventa obbligatorio ritornare all’idea di creare chirurgicamente una via extra-bulbare, cioè una bozza di scarico, anche se in maniera più conservativa rispetto alle tecniche tradizionali.
MIBS: Mini Invasive Bleb Surgery
A differenza delle strategie di deflusso MIGS sopra descritte, la via sottocongiuntivale non è fisiologica.
Tuttavia, il bersaglio chirurgico sottocongiuntivale è stato a lungo il pilastro dell’intervento chirurgico convenzionale per il glaucoma, con modalità chirurgiche tradizionali come la trabeculectomia e i dispositivi drenanti che impiegano questa via. La logica alla base dell’approccio mininvasivo a questo spazio si concentra principalmente sulla prevedibilità, sul controllo e, di conseguenza, sulla sicurezza.
Combinando le conoscenze già consolidate sulla guarigione delle ferite subcongiuntivali con i progressi nella fabbricazione dei dispositivi, la sempre migliore biocompatibilità dei materiali e l’uso sistematico degli antimitotici, lo spazio sottocongiuntivale offre un efficace percorso di deflusso per la riduzione della IOP. Naturalmente, la creazione del deflusso sub-congiuntivale comporterà la formazione di una bozza filtrante.
XEN = Stent Sottocongiuntivale Ab Interno
La prevedibilità e l’efficacia dei dispositivi sottocongiuntivali risiedono nelle leggi della idrodinamica.
Come descritto da Hagen e Poiseuille, la resistenza al deflusso è proporzionale alla lunghezza e al diametro del lume del tubo.
Sfruttare questi principi consente a un dispositivo di avere una resistenza al deflusso predeterminata consentendo allo stesso tempo un flusso acquoso immediato, ed un limite massimo al quale la IOP può abbassarsi, mitigando così il rischio di ipotonia e sequele associate.
Uno dei microstent più diffuso è proprio lo XEN, costituito da collagene porcino inizialmente prodotto con un lume interno di 45 µ e adesso con diametro maggiore (63 µ). Viene inserito generalmente ab interno e viene collocato nello spazio sottocongiuntivale del settore nasale superiore preparato con una iniezione di mitomicina, possibilmente rispettando le proporzioni approssimative di ¼ di lunghezza in camera anteriore, ¼ nel tragitto intrasclerale e 2/4 extrabulbari (Fig. 5).
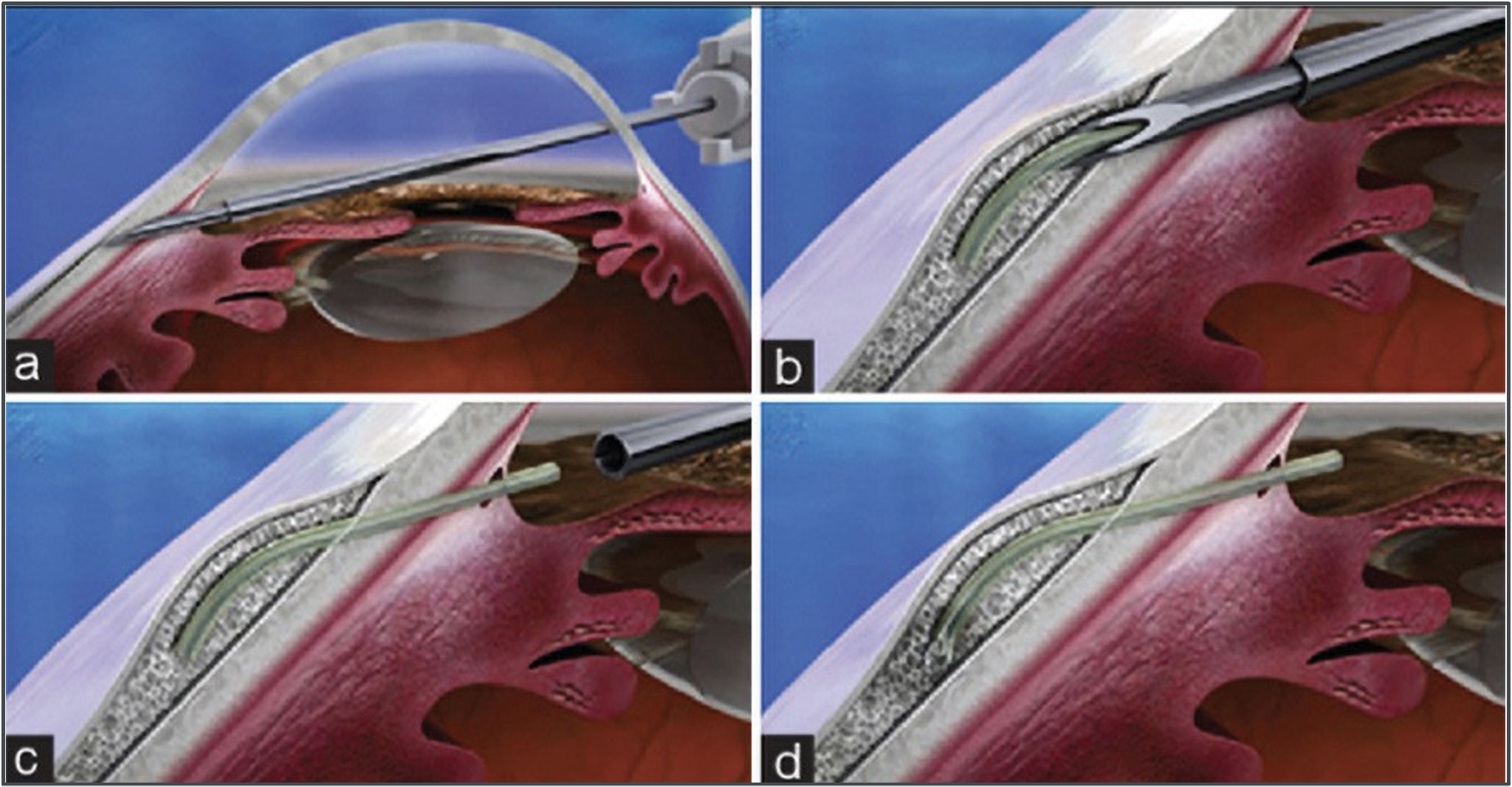
Fig. 5
Una recente review di autori italiani ha raccolto i dati fino a 4 anni del primo modello (45) e fino a 18 mesi del secondo e più recente (65). Secondo le evidenze pubblicate, il dispositivo XEN 45 abbassa la IOP di circa il 35% rispetto ai valori preoperatori, ottenendo un valore medio di IOP ≤15 mmHg, fino a 4 anni dopo l’intervento. Inoltre, XEN ha ridotto significativamente la necessità di farmaci ipotensivi oculari, con un numero medio di farmaci ipotensivi postoperatori ≤ 1 farmaco.
Sulla base delle prove e dell’opinione degli Autori, il dispositivo XEN può essere considerato la prima opzione chirurgica nei pazienti che necessitano di una IOP target di fascia medio-bassa. Anche se la trabeculectomia sembra avere un migliore effetto di riduzione della PIO, è stato dimostrato che il dispositivo XEN ha un profilo di sicurezza migliore.
Sebbene l’impianto del dispositivo XEN sia una procedura relativamente nuova, negli ultimi anni sono stati pubblicati numerosi studi che ne sottolineano il potenziale a lungo termine nel trattamento del glaucoma.
Tra le complicanze annoveriamo minime percentuali di ipoema, ipotalamia con piccoli sollevamenti coroideali, erosione congiuntivale e fibrosi cicatriziali a medio termine.
Restano da chiarire diverse questioni relative agli esiti clinici dello XEN, come il ruolo dell’etnia, i fattori che influenzano gli esiti, i tassi di interventi di needling o revisione necessari, l’impatto su glaucomi in miopia elevata e l’uso dello XEN in diversi tipi di glaucoma, compreso il glaucoma secondario.
PRESERFLO = Stent Sottocongiuntivale Ab Externo
L’ultimo dispositivo che prenderemo in considerazione è il PRESERFLO, un microstent composto da materiale sintetico derivato dallo stirene, lungo 8.5 mm, diametro interno 70 µ, composto da un tratto intrabulbare, una flangia stabilizzatrice ed una porzione da posizionare sotto la congiuntiva.
Il device va inserito dopo aver scollato il complesso capsulocongiuntivale, applicato soluzione di mitomicina, creato una microtasca episclerale destinata ad accogliere la flangia stabilizzatrice e infine perforato dall’apice della flangia verso la camera anteriore (Fig. 6).
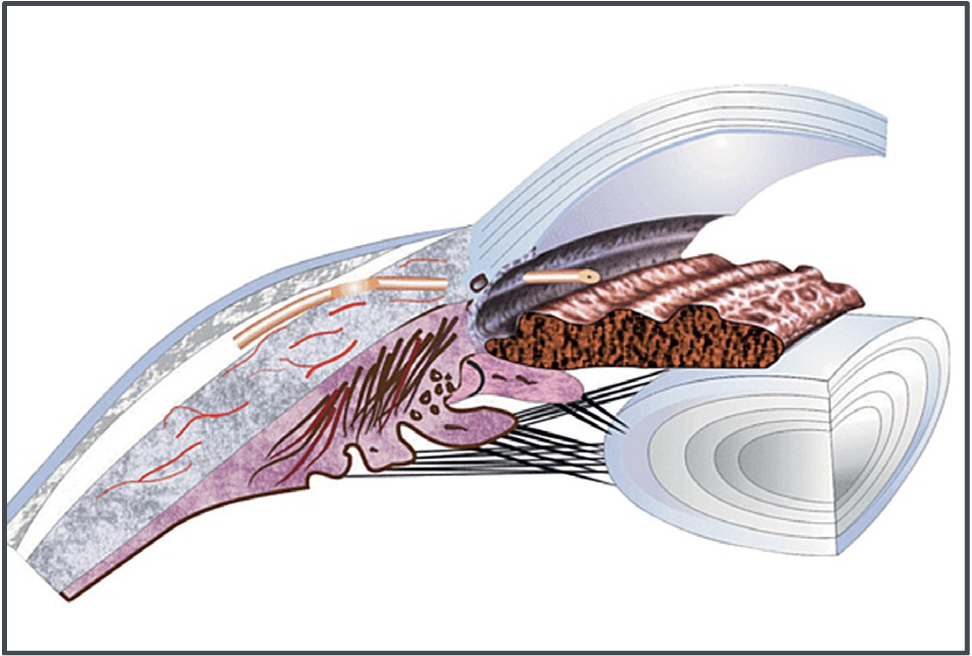
Fig. 6
Come si evince da questa descrizione, la tecnica sembra farci ritornare indietro ai tempi dell’EXPRESS che abbiamo citato all’inizio, ma le differenze sono fondamentali: ancora minore invasività per l’assenza della scolpitura di un flap sclerale, superiore biocompatibilità del materiale e del design ma soprattutto la differenza è nella direzione retroversa che la collocazione dello stent, a partire dai 3 mm dietro al limbus, conferisce alla filtrazione: in effetti la bozza va a collocarsi in posizione più arretrata rispetto alle filtranti anteriori (trab, express, sclerectomia profonda), in una zona dove la congiuntiva si dimostra essere meno reattiva perché è stata nel tempo meno insultata da farmaci e conservanti. Questo concetto di “filtrante intermedia” è stato accolto con gran favore da un numero sempre crescente di chirurghi del glaucoma abituato a riscontrare fallimenti delle filtranti anteriori per fibrosi cicatriziale.
In letteratura possiamo riscontrare che nei pazienti impiantati con Preserflo, la IOP mediamente si è ridotta da 20,1 mmHg al basale a 12,1 mmHg (diminuzione del 40%) a 12 mesi, e il valore della IOP è stato mantenuto a 12,1 mmHg a 24 mesi. Il numero medio di farmaci che abbassano la PIO è diminuito da 2,5 ± 1,4 e 2,3 ± 1,5 al basale, a 0,9 ± 1,2 e 0,7 ± 1,1 a 24 mesi di follow-up.
Anche per questo stent le complicanze si limi- tano a minime percentuali di ipoema, ipotalamia con piccoli sollevamenti coroideali, erosione congiuntivale e fibrosi cicatriziali a medio termine.
Conclusioni
L’era della chirurgia micro-invasiva del glaucoma è nel pieno del suo sviluppo e si diffonde tra gli expert glaucoma surgeons così come tra i phaco surgeons che vogliono dotarsi di una metodica nuova.
La comunità scientifica, dopo i primi scetticismi, si comincia ad aprire con un moderato ottimismo verso questo nuovo settore.
A nostro giudizio, l’atteggiamento più corretto sta innanzitutto nel diversificare ragionevolmente la vera chirurgia MIGS dalle minifiltranti, che con la denominazione di MIBS tendono a collocarsi in un ambito diverso per invasività ed efficacia.
Le prime infatti vengono destinate a una target pressure non particolarmente ridotta, possono contribuire ad un miglior controllo di pazienti poco complianti e sicuramente aiutano ad eliminare farmaci dalla superficie oculare, potendo in questo modo rappresentare anche una tappa intermedia per la preparazione del paziente ad una successiva filtrante maggiore con una congiuntiva meno reattiva. Richiedono una curva di apprendimento non banale, che riguarda soprattutto la posizione del chirurgo per la gonio-chirurgia e l’uso delle lenti per l’angolo (Fig. 7). Le seconde probabilmente si stanno diffondendo con maggiore rapidità per l’ergonomia di lavoro, più tradizionale ma soprattutto per le eccellenti doti di efficacia/sicurezza, ed è inte- ressante vedere come, in più occasioni, gli utilizzatori si stiano confrontando per capire fin dove l’asticella può essere alzata, ovverossia quante filtranti tradizionali e con quali valori pressori al baseline potranno in un prossimo futuro essere ragionevolmente sostituite da queste minifiltranti.
Fig. 7
Immutato rimane il problema dei costi di questi device, consistenti e soprattutto non inclusi nei DRG del SSN.
Resta una decisione delle direzioni strategiche destinare fondi per questo tipo di chirurgia così innovativa, fidandosi anche degli approfondimenti che sono stati fatti a livello di HTA e che hanno concluso con pareri favorevoli sul loro utilizzo.
Giusto il discorso teorico secondo il quale si investe nei device e si risparmia sui colliri, ma purtroppo il portamonete non è unico e la perequazione non è semplicissima.
Anche convincere il paziente che un minintervento sostituirà i suoi colliri non è compito semplice perché l’interessato non accetterà che milioni di altre persone mettono le gocce a proprio a lui questo viene scoraggiato a favore di un intervento chirurgico.
Crediamo dunque, pur con una certa attenzione ai costi di questi dispositivi, che se cerchiamo di conoscere meglio questo settore della chirurgia ipotonizzante, potremo un giorno avere più scelte, sì da destinare la tecnica giusta al caso giusto, senza aspettative infondate.
Mario Sbordone, Ada Orrico
U.O.C. Oculistica, Ospedale S. Maria Delle Grazie, Pozzuoli (NA)
Fonte: OftalmologiaDomani.it
 Eventi
Eventi